
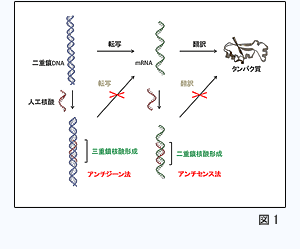
 遺伝情報はDNAからmRNA、タンパク質へと伝えられます。この一本鎖であるmRNAや遺伝子本体である二重鎖DNAに直接相互作用し、その遺伝情報を制御する手法は遺伝子治療薬の開発につながることが期待されます。mRNAを直接標的とした代表的な手法にアンチセンス法があります。それは病因となるmRNAの塩基配列に相補的な人工核酸を用い、二重鎖核酸を形成させることでタンパク質への翻訳を阻害する手法であります(図1)。このアンチセンス法を利用した医薬品(アンチセンス医薬品)は既に米国で使用されており、また臨床段階のアンチセンス医薬品も数多くあります。一方、二重鎖DNAを直接標的とした手法にアンチジーン法があります。アンチジーン法とは、人工核酸を用いて遺伝子の本体である二重鎖DNAと三重鎖核酸を形成させることで、その遺伝子発現を転写レベルで抑制する手法であります(図1)。しかし、このアンチジーン法には三重鎖核酸形成に由来する問題(標的二重鎖DNA配列の制限)があるため、現段階において実用的な手法とは言えません。 遺伝情報はDNAからmRNA、タンパク質へと伝えられます。この一本鎖であるmRNAや遺伝子本体である二重鎖DNAに直接相互作用し、その遺伝情報を制御する手法は遺伝子治療薬の開発につながることが期待されます。mRNAを直接標的とした代表的な手法にアンチセンス法があります。それは病因となるmRNAの塩基配列に相補的な人工核酸を用い、二重鎖核酸を形成させることでタンパク質への翻訳を阻害する手法であります(図1)。このアンチセンス法を利用した医薬品(アンチセンス医薬品)は既に米国で使用されており、また臨床段階のアンチセンス医薬品も数多くあります。一方、二重鎖DNAを直接標的とした手法にアンチジーン法があります。アンチジーン法とは、人工核酸を用いて遺伝子の本体である二重鎖DNAと三重鎖核酸を形成させることで、その遺伝子発現を転写レベルで抑制する手法であります(図1)。しかし、このアンチジーン法には三重鎖核酸形成に由来する問題(標的二重鎖DNA配列の制限)があるため、現段階において実用的な手法とは言えません。
| 2. アンチジーン法の実用化を妨げる問題(標的二重鎖DNA配列の制限) |
|
|
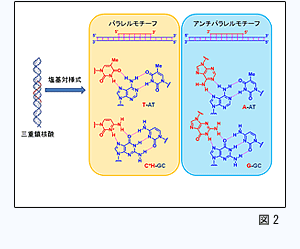 アンチジーン法の基本原理である三重鎖核酸形成の塩基対様式は図2に示すとおりであります。三重鎖核酸を形成するためには、二重鎖DNAの標的鎖の塩基配列はプリン塩基であるAあるいはGの連なったポリプリン領域でなければなりません。例えば、標的鎖の塩基配列にピリミジン塩基(CやT)が含まれる場合、CやTを選択的かつ強固に認識できる核酸塩基が存在しないため、塩基配列選択性がなく三重鎖核酸の安定性も著しく低下します。また、ポリプリン領域を標的とした場合でも、生理的条件下における三重鎖核酸の安定性が十分でない等の問題もあります。 アンチジーン法の基本原理である三重鎖核酸形成の塩基対様式は図2に示すとおりであります。三重鎖核酸を形成するためには、二重鎖DNAの標的鎖の塩基配列はプリン塩基であるAあるいはGの連なったポリプリン領域でなければなりません。例えば、標的鎖の塩基配列にピリミジン塩基(CやT)が含まれる場合、CやTを選択的かつ強固に認識できる核酸塩基が存在しないため、塩基配列選択性がなく三重鎖核酸の安定性も著しく低下します。また、ポリプリン領域を標的とした場合でも、生理的条件下における三重鎖核酸の安定性が十分でない等の問題もあります。
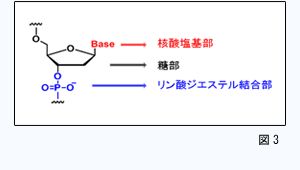
本研究では、有機合成化学的手法を活用して、標的二重鎖DNA配列の制限を克服しうる人工核酸の開発を行います。その開発には、塩基対を認識する核酸塩基部だけでなく、糖部、リン酸ジエステル結合部に関しても(図3)、それぞれ化学修飾アナログの検討を行い、最終
的にはそれら各部の修飾構造を融合するといったアプローチを計画し
 ています。また、本研究ならびに創薬研究に有用な新規合成方法論(複素環合成法)の開発も行います。最終的には、アンチジーン法に限らず、三重鎖核酸を基盤とする様々な応用技術に適用できる人工核酸の開発を目指します。
ています。また、本研究ならびに創薬研究に有用な新規合成方法論(複素環合成法)の開発も行います。最終的には、アンチジーン法に限らず、三重鎖核酸を基盤とする様々な応用技術に適用できる人工核酸の開発を目指します。
|