
| 1. RNA編集による生命現象調節メカニズムの解明 |
|
|
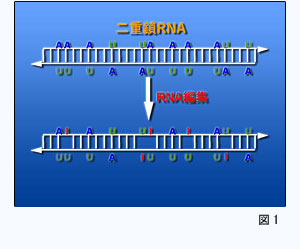 RNA編集は、二重鎖RNA中のアデノシンをイノシンへと置換する現象です。スプライシングなどと同じ転写後修飾の一種で、線虫から哺乳類まで幅広く保存されています (図1)。 RNA編集は、二重鎖RNA中のアデノシンをイノシンへと置換する現象です。スプライシングなどと同じ転写後修飾の一種で、線虫から哺乳類まで幅広く保存されています (図1)。
RNA編集がタンパク質翻訳領域に生じた場合、アミノ酸配列が変わり生理学的性質も変化させるため極めて重要です。このようなケースは、哺乳類ではグルタミン酸受容体GluR2サブユニットやセロトニン5-HT2CRなど約15遺伝子に同定されています。GluR2のRNA編集は、受容体のCa2+イオン透過性を規定しており、このRNA編集を阻止すると神経細胞死が起こります (Brusa et al, Science, 2005)。私たちは、これまでに筋萎縮性側索硬化症 (ALS)と呼ばれる神経難病の主病変である運動ニューロンにおいて、このGluR2のRNA編集が選択的に低下していることを発見し、病態と一次的に関連していることを報告してきました (Kawahara et al, J Neurochem, 2003; Kawahara et al, Nature, 2004など)。また、脳特異的に発現している5-HT2CR受容体のRNA編集は、Gタンパク質を介した信号伝達効率を制御しています。RNA編集を受けた受容体だけを発現するノックインマウスは、生後から痩せ、行動量が明らかに減少します(Kawahara et al, J Neurosci, 2008)。この結果から、このRNA編集がエネルギー代謝や行動を制御していることを明らかにしました。
このように、ゲノムに規定されないRNA編集というエピジェネティックな転写後修飾は、様々な生命現象を制御しており、その異常は、非遺伝性疾患 (例えばALS, 肥満, 精神疾患)の病態と深く関連しています。私たちは今後も、RNA 編集がどのような生命現象と関連し、その異常がどのような病気の原因となっているのかを解明していきます。
| 2. マイクロRNAの脳神経系における生理的役割の解明 |
|
|
マイクロRNA は、21塩基前後の小さなnon-coding RNAで、二重鎖RNAから生成された後、標的遺伝子へと結合してその発現量を調節しています。近年、マイクロRNAは、細胞の発生・分化や固有の機能維持に必須の因子であることが明らかにされ、既にヒトでは700以上もの種類があることが分かっています。
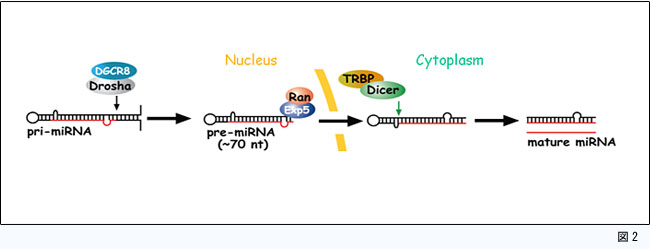
マイクロRNAは、まず数百〜数千塩基程度のprimary-miRNA (pri-miRNA)として核内で転写されます (図2)。この際、pri-miRNAは部分的にヘアピン構造を持った不完全二重鎖RNAを形成し、これをDrosha/DGCR8複合体が認識することによって、70-120塩基前後のprecusor miRNA (pre-miRNA)へと切断します (図2)。その後pre-miRNAは、核から細胞質へと輸送され、Dicer/TRBP複合体によってループ近傍が切断され、成熟型マイクロRNAとなります (図2)。その後、複数のmRNAの3’非翻訳領域 へと結合し、タンパク質への翻訳を抑制したり、mRNAを直接分解するなどして、遺伝子発現を調節しています。
これまで、マイクロRNAの発現や機能がどのように調節されているのか分かりませんでしたが、私たちはRNA編集が重要な調節因子の1つであることを明らかにしてきました (Kawahara et al, Science, 2007; Kawahara et al, EMBO Rep., 2007; Kawahara et al, Nucleic Acids Res., 2008)。
現在、ヒトの脳には約500種類くらいマイクロRNAが発現していることが知られています (Berezikov et al, Nat. Genet., 2006)。マイクロRNAの生成に必須のDicerを、ある神経細胞特異的にノックアウトすると、細胞死が生じたり、細胞固有の機能が失われたりすることが知られています(Schaefer et al, J. Exp. Med., 2007など)。このことから、各神経細胞によってマイクロRNAによる調節機能は異なっていることが分かりますが、約500種類あるマイクロRNAの中で、具体的に機能の判明しているものはまだ極僅かです。私たちは、神経細胞の発生・分化、あるいは個々の細胞が持つ固有の機能を調節しているマイクロRNAを同定していきます。また、マイクロRNAによる遺伝子発現制御メカニズムの異常が、どのような神経疾患と関連しているのかを解明し、将来マイクロRNAを用いた疾患の診断や治療への応用を目指します。
|